Elsevier MDLがFDA申請文書の検索・閲覧サービスを開始
安全性情報を手早く取得、1992年以降のすべての承認薬を網羅
2006.05.26−Elsevier MDL(エルゼビアMDL)は、米食品医薬品局(FDA)への新薬申請文書を手元のパソコンから検索・閲覧できるようにする新サービス「PharmaPendium」(ファーマペンディアム)を提供開始した。1992年以降に米国で承認されたすべての医薬品情報が収められており、前臨床/臨床/市販後調査の各段階で得られた実験データも収録されている。新薬開発に当たって、既存薬の安全性情報を調べる際に有効に利用できるほか、創薬研究のツールとしても役立つ。利用料金は、5指名ユーザーで年間約200万円。
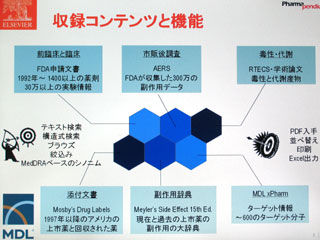 PharmaPendiumは、FDAの医薬品評価・研究センター(CDER)が公開している承認薬データベース「Drugs@FDA」(http://www.accessdata.fda.gov/scripts/cder/drugsatfda/)の情報を商用版として提供するサービス。オリジナル版は、申請文書をスキャナーで読み取り、そのイメージをPDFファイルに変換したもの。 PharmaPendiumで閲覧できるのもPDF文書だが、テキスト情報が含まれているため、全文検索を行うことができる。また、実験データの数値なども含めて、検索結果をエクセル形式でダウンロードすることも可能である。
PharmaPendiumは、FDAの医薬品評価・研究センター(CDER)が公開している承認薬データベース「Drugs@FDA」(http://www.accessdata.fda.gov/scripts/cder/drugsatfda/)の情報を商用版として提供するサービス。オリジナル版は、申請文書をスキャナーで読み取り、そのイメージをPDFファイルに変換したもの。 PharmaPendiumで閲覧できるのもPDF文書だが、テキスト情報が含まれているため、全文検索を行うことができる。また、実験データの数値なども含めて、検索結果をエクセル形式でダウンロードすることも可能である。
情報量としては、オリジナル版が1998年以降の承認薬に限られているのに対し、1992年以降の1,400以上の承認薬情報を収録。FDAのレビュー、添付文書の更新、警告のすべてを含んでおり、トータルでは約70万ページの情報にアクセスすることができる。実際の文書をスキャンしたものであるため、余白にFDA担当官の手書きメモが付いている場合もあるという。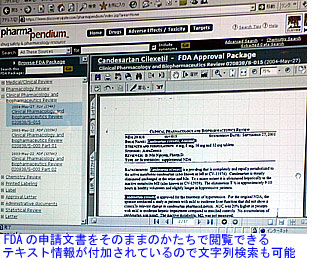
検索機能については、自由なキーワードで全文検索ができるほか、薬剤の名称や構造式での検索、作用メカニズム(ターゲット名)や副作用などで分類された薬剤リストから目的の情報を探すことが可能。強力な同義語辞書を搭載しているため、キーワードのゆれによる検索もれも起こりにくい。薬剤名と副作用、動物種を指定してピンポイントで安全性情報を検索することも容易となっている。
さらに、PharmaPendiumは、エルゼビアMDLの製薬業向け総合情報サービスである「ディスカバリーゲート」に統合されているため、他のコンテンツサービスとリンクできることも大きな特徴。豊富な情報をさまざまな角度から掘り下げることができる。
 PharmaPendiumは、FDAの医薬品評価・研究センター(CDER)が公開している承認薬データベース「Drugs@FDA」(http://www.accessdata.fda.gov/scripts/cder/drugsatfda/)の情報を商用版として提供するサービス。オリジナル版は、申請文書をスキャナーで読み取り、そのイメージをPDFファイルに変換したもの。 PharmaPendiumで閲覧できるのもPDF文書だが、テキスト情報が含まれているため、全文検索を行うことができる。また、実験データの数値なども含めて、検索結果をエクセル形式でダウンロードすることも可能である。
PharmaPendiumは、FDAの医薬品評価・研究センター(CDER)が公開している承認薬データベース「Drugs@FDA」(http://www.accessdata.fda.gov/scripts/cder/drugsatfda/)の情報を商用版として提供するサービス。オリジナル版は、申請文書をスキャナーで読み取り、そのイメージをPDFファイルに変換したもの。 PharmaPendiumで閲覧できるのもPDF文書だが、テキスト情報が含まれているため、全文検索を行うことができる。また、実験データの数値なども含めて、検索結果をエクセル形式でダウンロードすることも可能である。
